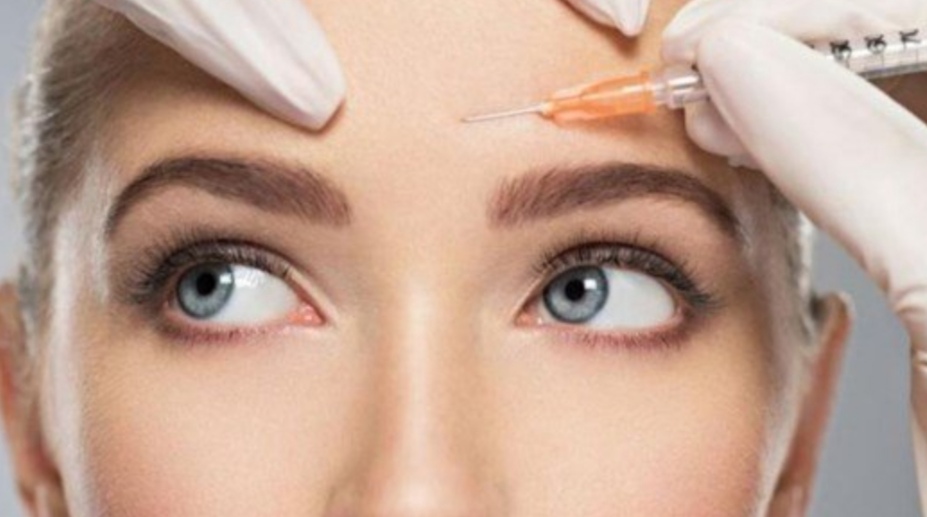
أعطت إدارة الغذاء والدواء (FDA) علاجاً مضاداً للتجاعيد عن طريق الحقن والذي يستمر لمدة شهرين تقريبًا أطول من البوتوكس، الضوء الأخضر لاستخدامه للبالغين.
ويصبح الأوّل من نوعه الذي يحصل على الموافقة منذ أكثر من عقد.
ويتم حقن Daxxify – المصنع من قبل Revance – في خطوط الوجه وحول العينين. ويستمر لمدة ستة أشهر تقريبًا، متجاوزاً فترة الثلاثة إلى الأربعة أشهر لمنافسه الرئيسي البوتوكس.
وقال الرئيس التنفيذي لشركة التكنولوجيا الحيوية ومقرها تينيسي مارك فولي، إنها تحقق بالفعل فيما إذا كان من الممكن استخدامه أيضا لعلاج تشنجات الشفاه وخلل التوتر في عنق الرحم – عندما تنقبض عضلات الرقبة بشكل لا إرادي.
ويعمل Daxxify بنفس الطريقة التي يعمل بها البوتوكس، وهو عامل منع عصبي عضلي يعمل على تجميد العضلات بشكل فعال، ما يساعد على منع التجاعيد.
ويأمل مطوروه في تشجيع المزيد من الأشخاص على التحول إلى العلاج لأنه يتطلب عدداً أقل من الحقن كل عام.
ويحتاج عملاء البوتوكس عموماً إلى ثلاث جرعات على الأقل سنويّاً، ولكن مع Daxxify يمكن تقليل هذا إلى اثنتين بنفس تأثيرات العلاج.
ولم يتم الكشف عن سعر العلاج الجديد، لكن منافسه الرئيسي يكلف عادة ما بين 250 دولاراً و500 دولار لكل حقنة في كل منطقة معالجة.
وقال فولي إنهم يخططون لنشره في عدد قليل من الصيدليات أوّلًا، لم يتم الكشف عن مواقعها، لاستخدامها بين بعض المرضى فقط. وبعد ذلك سيتم إتاحته تجاريًّا.
ويعد Daxxify أول علاج يستخدم الببتيدات للحفاظ على ثبات الصيغة، بدلا من البروتينات الحيوانية أو البشرية المستخدمة عادة.
وكشفت إدارة الغذاء والدواء الأميركية أنّ العلاج قد تمت الموافقة عليه للاستخدام في البالغين في قائمة الأدوية المبتكرة التي نشرت هذا الأسبوع.
واستندت الموافقة على تجارب المرحلة 3 التي شملت 2700 مريض وأكثر من 4200 حقنة.
وأظهرت النتائج أن 74% من الأشخاص شهدوا تحسنًا في الخطوط بعد أربعة أسابيع من العلاج.
واستمر لمدة ستة أشهر في المتوسط - حيث قال بعض المرضى إنه كان لا يزال يعمل بعد تسعة أشهر.
وكان التأثير الجانبي الأكثر شيوعا للعلاج هو الصداع (عانى ستة في المئة من المشاركين)، يليه تدلي الجفن (2%).
ولم يعان أي شخص من ضعف في العضلات أو صعوبات في التنفس، لكن إدارة الغذاء والدواء الأميركية حذرت من أن هذا قد يحدث عند استخدام العلاج.
وقال فولي إن Daxxify سيكون “ابتكاراً تجريبيًّا” ويمثل تتويجًا لـ “سنوات من البحث والتطوير الرائدين”. وكان المنتج في انتظار الضوء الأخضر لفترة طويلة، مع تأجيل الفحص الأول في تشرين الثاني 2020 بسبب جائحة كوفيد.